חוקרים מאוניברסיטת תל אביב הפריכו את מודל קבוצת החלבונים COPII – ופתחו פתח לדור חדש של תרופות למחלות גנטיות


מחקר
חוקרים מאוניברסיטת תל אביב הפריכו את מודל קבוצת החלבונים COPII – ופתחו פתח לדור חדש של תרופות למחלות גנטיות

"ב-2013 זכה הביולוג האמריקאי רנדי שקמן בפרס נובל לרפואה על גילוי קבוצת חלבונים בשם COPII. מאז התגלית של שקמן, שכמובן קדמה לפרס בשנים רבות, חוקרים רבים אפיינו את הקבוצה – והיום מקובל לחשוב שחלבוני ה-COPII משמשים כמעטפת של בועיות, או וסיקולות, שמעבירות חלבונים בין אברונים בתוך התא," מסביר פרופ' כורת הירשברג מהמחלקה לפתולוגיה בפקולטה לרפואה ע"ש סאקלר. "הטענה מבוססת עד כדי כך שהיא כבר מופיעה בספרי הלימוד בביולוגיה. הבעיה הייתה בעיקר שכל אותם חוקרים בודדו את החלבונים האלה במבחנה, ובאמת נוצרו בועיות, אבל זה בכלל לא התפקיד של ה-COPII במערכות חיות. הרי לא כל מה שקורה לחלבונים מבודדים במבחנה קורה גם בתא השלם".
כעת, חוקרים מאוניברסיטת תל אביב בהובלת בהובלת פרופ' הירשברג, הפריכו את התיאוריה המדעית המבוססת לגבי קבוצת החלבונים הזאת. באמצעות מערכת המניפולציה הגנטית CRISPER, החוקרים הראו שחלבונים אלו אינם משמשים ליצירת בועיות להעברת חלבונים בין אברונים בתוך התא, אלא דווקא למיון אחרון של החלבונים היוצאים לדרכם. הממצאים המפתיעים, שהתפרסמו בכתב העת היוקרתי Journal of Cell Biology, יכולים לשמש בעתיד לטיפול במגוון רחב של מחלות גנטיות.
הקריספר (ראשי תיבות של Clustered Regularly Interspaced Short Palindromic Repeats) הוא אזור ב-DNA שמורכב מרצפים חוזרניים קצרים, שמכילים גם קטעי דנ"א של בקטריופאג'ים - נגיפים שתוקפים חיידקים, והוא חלק ממנגנון הגנה מפני נגיפים. כדי לבחון את המודל שלהם לתפקיד החלבונים במערכת ההסעה התוך-תאית, החוקרים השתמשו בשילוב מערכות מתקדמות של מיקרוסקופים מבוססי קרני לייזר להדמיית תאים חיים, יחד עם מערכת המניפולציה הגנטית החדשנית CRISPER.
"לקחנו חלבון פלואורסצנטי שהמקור שלו במדוזות, אשר פולט אור אדום בחשיפה לאור ירוק", אומר פרופ' הירשברג. "באמצעות שיטת CRISPER גרמנו לאיחוי החלבונים הפלואורסצנטיים עם חלבוני ה-COPII בתוך החומר הגנטי של תאי HeLa ממקור אנושי, כך שיכולנו לעקוב אחר התנועה שלהם בזמן אמיתי בתוך התא. והתוצאה הייתה מובהקת: חלבוני ה-COPII לא רק שלא זזו כלל, וגם לא יצרו את הבועיות, אלא ישבו דרך קבע על גבי הממברנה של אברון ענק הידוע בשם הרטיקולום אנדופלזמטי. אברון זה אחראי בין היתר על מערכת בקרת האיכות של ייצור החלבונים של התא. הוא מחליט אילו חלבונים יוסעו בבועיות ולאן יגיעו. אבל אין פירושו של דבר שחלבוני ה-COPII אין תפקיד במערכת ההסעה. להפך: מצאנו כי הם שומרי הסף האחרונים לפני יצירת בועיות ההסעה, כשהם תוחמים מבנים מוגדרים על קרום הרטיקולום האנדופלזמטי בשם ER exit sites. שם, תחת בקרת חלבוני ,COPII מתרכזים החלבונים שאמורים לנוע בבועיות. כך שלחלבוני COPII יש את ה'מילה האחרונה' בשאלה מי מתאים לצאת ומי לא".
לדברי פרופ' הירשברג, למודל החדש מאוניברסיטת תל אביב השלכות מעשיות מאוד. "מחלות גנטיות רבות, כמו סיסטיק פיברוזיס למשל, נגרמות ממוטציות בחלבונים, שמערכת בקרת האיכות של התא לא מזהה וחוסמת את תנועתם. אם קומפלקס החלבונים של COPII הוא זה שמחליט אם החלבון מתאים או לא לצאת החוצה מהאברון, לפנינו מטרה לסוג חדש של תרופות. אולי מניפולציה של החלבונים הללו תאפשר לנו לקבוע מי ייצא ומי לא".

מחקר
אוניברסיטת תל אביב שיגרה לחלל "חומר חכם" - פולימר מקופל שנפרס לצורתו המקורית בחימום, והוא יקיף את כדור הארץ במסלול

הלוויין TAUSAT-1 של אוניברסיטת תל אביב והמרכז למחקר גרעיני (ממ"ג) שורק, ששוגר לאחרונה לחלל, ממשיך לעשות היסטוריה: ב-9 באפריל, בשעה שבע בערב (שעון ישראל), ניתן האות ממרכז הבקרה באוניברסיטת תל אביב, וחומר חכם בעל זיכרון צורני (shape memory polymer, או SMP), שינה את צורתו ונפרס במסלול סביב כדור הארץ. זאת הפעם הראשונה שחומר חכם משוגר מישראל לחלל. מנגנון הפריסה שפותח יוכל לחסוך בעתיד את הצורך לשגר מנגנונים כבדי משקל, ולשמש לפריסת רכיבים שונים כמו לוחות סולאריים ואנטנות.
"מדובר באקטואטור - רכיב שאחראי להנעת חלקים ומערכות - על בסיס פולימר משנה צורה", אומר פרופ' נעם אליעז מהמחלקה למדע והנדסה של חומרים בפקולטה להנדסה ע"ש אידי ואלדר פליישמן. האקטואטור פותח במסגרת עבודת המאסטר של דבי מרגוי ובהנחיה משותפת של פרופ' אליעז וד"ר רונן ורקר מממ"ג שורק. הפולימר החכם הוא ניסוי אחד מבין חמישה שעורך TAUSAT-1 במעבדה מוטסת זעירה, בגודל של 10×10×10 ס"מ, שפותחה על ידי מחלקת סביבת חלל בממ"ג.
"היו עוד ננו-לוויינים ששוגרו מישראל, חלקם הצליחו וחלקם לא, אבל זאת הפעם הראשונה שמשוגר מישראל לוויין עם מנגנון פריסה של פולימר משנה צורה. הפולימרים האלה הם חומרים חכמים שיכולים לחזור לצורתם המקורית עקב גירוי חיצוני כמו אור, חום, שדה חשמלי או שדה מגנטי", אומר פרופ' אליעז.
"חומרים חכמים הם פתרון עתידני ויצירתי לצורך שיגור מנגנוני פריסה מתכתיים כבדי משקל", מוסיף ד"ר רונן ורקר. "חומרים חכמים מאפשרים לנו לשלוט בתהליך הפריסה ללא מגע פיזי וללא קשר עין עם מרכז הבקרה, ולחסוך דרמטית במסה ובנפח של המטען המשוגר לחלל. האקטואטור שפיתחנו נפרס בתגובה לחום. בנוסף, זווית הכיפוף של האקטואטור גם משנה את ההתנגדות החשמלית שלו, ובאמצעות מדידת ההתנגדות החשמלית אפשר לקבל אינדיקציה לכך שהוא אכן נפרס בהצלחה".
המעבדה המוטסת של TAUSAT-1 מכילה שורה של ניסויים מדעיים נוספים, שנועדו לחקור את סביבת החלל במטרה למצוא פתרונות טובים יותר לשיגור ולתפעול של לוויינים וחלליות בסביבה זו, בהם גם מדידת קרינה מייננת מצטברת באמצעות גלאי טרנזיסטור בעל שכבת תחמוצת עבה, ההופכת אותו לרגיש מאוד לקרינה מצטברת. מערכת הניסוי מודדת את השתנות ערכי מתח הסף להפעלת הטרנזיסטור באופן רציף ולאורך זמן, וכך מאפשרת מדידה גם של מנות קרינה נמוכות במיוחד.
הננו לוויין אופיין, פותח, הורכב ונבדק במסגרת המרכז לננו-לוויינים בקמפוס, שיתוף פעולה ייחודי בין הפקולטה להנדסה ע"ש איבי ואלדר פליישמן ובית הספר פורטר לסביבה ומדעי כדור הארץ, בפקולטה למדעים מדויקים לבין המרכז למחקר גרעיני - שורק.
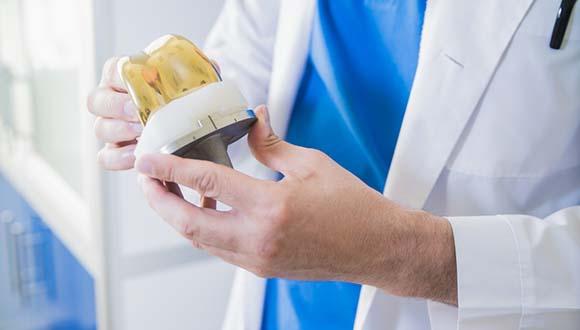
מחקר
מולקולה שפותחה במטרה לטפל באלצהיימר ואימפוטנציה התגלתה כיעילה במיוחד למניעת דלקות בשתלים אורטופדיים

לשתלים דנטליים ואורתופדיים שימוש נפוץ ביותר בעולם. אחת הסיבות העיקריות לכישלון השתל היא תגובה חיסונית כנגד חיידקים בפה והשלת חלקיקי טיטניום ממנו מורכב השתל. אלה ועוד גורמים אחרים מעוררים תגובה דלקתית המובילה להפעלתם של תאים סופגי עצם (אוסטאוקלסטים) והרס העצם (אוסטיאוליזה) סביב השתלים. אחרי שהתהליך מתחיל, כמעט ולא ניתן לשלוט בו, והוא גורם, בסופו של דבר, לאובדן השתל. תהליך דומה קורה סביב שיניים, שם חיידקים הם הגורם העיקרי, וספיגת העצם מופעלת ע"י התגובה החיסונית ותאי הדלקת.
חוקרים מאוניברסיטת תל אביב פיתחו מולקולה (SNV) המבוססת על פפטיד מעיים וזואקטיבי (VIP), שהוא למעשה חלבון קצר יציב, העשויה לעכב באופן משמעותי הן את הדלקת והן את הרס העצם. הטכנולוגיה תסייע לאנשים עם שתלים אורתופדיים, למשל אנשים שעברו השתלות ברך, לאנשים עם שתלים דנטליים אשר עברו השתלות שיניים, ולאנשים שסובלים מנסיגת חניכיים (שהיא למעשה נסיגת עצם) ושיניים ניידות בשל מחלת חניכיים.
VIP פועל כנוירו-הורמון וכנוירוטרנסמיטר (מוליך עצבים) הקשור לפעולות פיזיולוגיות רבות כגון הרחבת כלי דם, הרחבת דרכי אוויר, חלוקת תאים והגנה עצבית. החוקרים הפכו את החלבון לשומני לצורך יכולת החדרתו דרך העור, כך שיוכל לשמש כתרופה בצורת משחה.
המחקר של פרופ' ינקל גבט, פרופ' דוד כוכבי, פרופ' אילנה גוזס, ד"ר דוד דנגור וד"ר מיכל אגר מהפקולטה לרפואה ע"ש סאקלר באוניברסיטת תל אביב, יוצג לראשונה במאמר שיתפרסם בקרוב בכתב העת Frontiers in Pharmacology, והוא כולל גם עבודת הכנה לניסוי קליני וגם תוצאות מעמיקות של חדירות SNV דרך העור. הטיפול יירשם כפטנט חדש.
"לאחרונה נפגשתי עם חברים וקרובים שעברו השתלות ברך והשתלות שיניים, ואני מבינה את הצורך הרב של החולים בתרופות מסוג זה ומקווה שנוכל לעזור," מספרת פרופ' אילנה גוזס. "עבדתי שנים רבות על VIP - ההורמון החלבוני החשוב ששומר על חיוניות תאי מוח מחד וחשוב לפעילות המינית מאידך. היינו הראשונים בעולם שבידדו את הגן של VIP, בעידן שבו שיבוט גנים היה בחיתולים, וגם הראשונים בפיתוח תרופות עתידניות ע"י חיבור VIP החלבוני לשייר שומני ליצירת SNV – מולקולה שיכולה לחדור דרך העור ולשמש כתרופה במשחה. באותה תקופה ניסינו בעזרת המולקולה לפתור בעיות של אימפוטנציה ואלצהיימר, בשיתוף עם פרופ' מתי פרידקין במכון ויצמן. לאחרונה, נקרה לדרכי כיוון מחקרי אחר לגמרי, שבמסגרתו גילינו כי SNV מגנה ביעילות על עצמות כנגד תהליכים דלקתיים המעוררים ספיגת עצם".
במהלך הניסויים הראשונים נבדקה השפעת המולקולה על תאי עצם ותאים ממערכת החיסון. בשלב זה כבר התגלה כי חלקיקי מתכות שמקורם משתלים גורמים לספיגת עצם מואצת. בבדיקת המולקולה במודל חיות, החוקרים נדהמו לגלות כי בנוכחות SNV תהליך ספיגת העצם נבלם בצורה משמעותית. כתוצאה מכך התהליך עשוי לרסן או למנוע ספיגת עצם, וכך לשמור על אחיזת השתלים והשיניים בעצם הסובבת אותם. "תוצאות אלה הושגו, בין היתר, בזכות החיבור בין קלינאים לחוקרים שאיפשר מתן מענה מחקרי לפער קליני" מסבירה ד"ר מיכל אגר מבית הספר לרפואת שיניים ע"ש מוריס וגבריאלה גולדשלגר.
פרופ' ינקל גבט מסכם: "הפרויקט הוא דוגמה קלסית של שיתוף פעולה בין מחלקות שונות בפקולטה לרפואה באוניברסיטת תל אביב. מצד אחד, בשיתוף עם פרופ' דוד כוכבי, הקבוצה שלי חוקרת מזה שנים את הקשר בין מערכת החיסון, תגובה דלקתית ותאי עצם. מצד שני, ד"ר מיכל אגר היא רופאת שיניים שהחליטה לחקור את התהליכים האלה במסגרת עבודת הדוקטורט שלה. היא השתתפה בקורס של פרופ' גוזס שכלל את VIP ו-SNV ואחרי שיחה מעמיקה נולד הרעיון לבדוק אם מולקולות אלה יכולות למנוע איבוד עצם סביב שתלים או שיניים. מהר מאוד גילינו את הפוטנציאל האדיר של SNV לאנשים שסובלים מאיבוד עצם סביב שיניים ושתלים, ואנחנו עמלים להביא את ההמצאה הזאת לקליניקה בקרוב".
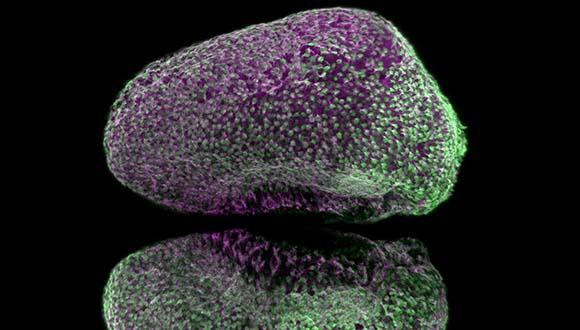
מחקר
מחקר חדש על מוח של דגי הזברה הוכיח שנוירונים חדשים נוצרים במוח באופן מסודר ומתואם

"במוחם של כל בעלי החוליות, כולל בני אדם, קיימים תאי גזע הממוקמים על קליפת המוח, ותפקידם לייצר נוירונים חדשים (בניגוד לתאי גזע עובריים, שיכולים להתמיין לכל סוגי התאים הקיימים בגוף, תאי גזע אלה יכולים לייצר אך ורק נוירונים או תאי גזע נוספים). אצל האדם תאים אלה פעילים בעיקר בגיל הילדות, במהלך התפתחות המוח. אצל אדם בוגר הם רדומים בדרך כלל, ומתעוררים לפעולה רק לעתים נדירות, בעיקר במקרה של פגיעה במוח - כדי לחדש רקמות נוירונים שנפגעו, ולתקן את הנזק במידת האפשר." מסביר פרופ' דוד שפרינצק מבית הספר לנוירו-ביולוגיה, ביוכימיה וביופיזיקה של הפקולטה למדעי החיים ע"ש ג'ורג' ס' וויז.
פרופ' שפרינצק מוסיף כי במחלות ניווניות של המוח, כמו פרקינסון ואלצהיימר, התהליך משתבש ונצפית ירידה במספר תאי הגזע במוח ובקצב ההתרבות שלהם. במקרים של סרטן המוח, לעומת זאת, תאים שונים במוח הופכים בחזרה לתאי גזע, ואז עוברים שפעול-יתר ומתרבים באופן בלתי מבוקר.
כעת, צוות מחקר בראשותו, יצר בעזרת דגי זברה הדמיה (סימולציה) מתקדמת של תהליך מפתח במוח: שפעול (אקטיבציה) של תאי גזע האחראים ליצירת נוירונים. ההדמיה העלתה כי התהליך, שנחשב עד היום לאקראי, הוא למעשה מאורגן ומתואם, וכך הוא מבטיח התפתחות תקינה של הנוירונים במוח. לדברי החוקרים, ממצאיהם תורמים נדבך חדש להבנת התפתחות המוח, וכן לחקר פגיעות ומחלות הקשורות לנוירונים, כמו סרטן המוח, מחלות ניווניות כמו אלצהיימר ופרקינסון ונזק מוחי לסוגיו. ההדמיה התבססה על צילומים בטכנולוגיה חדשנית של המוח בדגי זברה.
המחקר הובל על ידי פרופ' דוד שפרינצק ותלמיד המחקר אודי בינשטוק מהפקולטה למדעי החיים באוניברסיטת תל אביב, ופרופ' לור באלי-קוייף (Laure Bally-Cuif) וצוותה ממכון פסטר של המכון הלאומי למחקר מדעי בצרפת. המאמר פורסם בכתב העת Cell Stem Cell.
לדברי החוקרים, המחקר הנוכחי ביקש לבחון את המנגנון המעיר את תאי הגזע במוח כדי שיתחילו להתחלק: "עד היום נחשבה ההתעוררות לאקראית, ואנחנו רצינו לבדוק אם יש בה סדר כלשהו, והאם התעוררות של תא גזע אחד משפיעה על האחרים", מציין פרופ' שפרינצק. "לצורך כך ביצענו מחקר בדגי זברה, תחום התמחותה של המעבדה במכון פסטר שבצרפת. דגי הזברה נבחרו מכיוון שתאי הגזע במוחם דומים לאלה של יונקים, אך פעילים הרבה יותר, כך שהנוירונים במוחם מתחדשים ללא הרף".
במסגרת המחקר נעשה שימוש בטכנולוגיית צילום מתקדמת המאפשרת לצלם את מוחו של הדג כאשר הוא חי ופעיל. החוקרים ביצעו צילום מדי שלושה ימים במשך שבועות אחדים, וכך נוצר רצף תמונות המראה את תהליך ההתפתחות וההתחדשות במוח.
נתונים אלה הועברו למעבדתו של פרופ' שפרינצק באוניברסיטת תל אביב, שניתחה אותם ובנתה הדמיה חישובית של תהליך התעוררות תאי הגזע במוח. לדברי פרופ' שפרינצק, "התגלית העיקרית שלנו היא, שבניגוד למה שסברו המדענים עד היום, התהליך אינו אקראי. הנוירונים החדשים נוצרים באופן מסודר ומתואם." המודל החישובי הראה בבירור שתא גזע העובר שפעול (אקטיבציה) אינו מאפשר לתאים הסמוכים אליו לעבור תהליך דומה במשך כמה ימים. בדרך זו הוא מבטיח שהנוירונים המיוצרים יהיו מסודרים במוח בצורה תקינה. ממצא זה חשוב מאוד להבנת ההתפתחות והמבנה התקין של המוח.
"המחקר שלנו מוסיף נדבך חשוב להבנת התפתחות המוח. הוא עשוי לסייע לפיתוח טיפולים עתידיים לפגיעות מוחיות ולמחלות ניווניות של המוח כמו אלצהיימר ופרקינסון, על ידי שפעול תאי הגזע לייצור נוירונים חדשים. כמו כן הוא מקדם את הבנת המנגנון של התפתחות סרטן המוח, כתשתית אפשרית לטיפולים שינטרלו את התהליך הסרטני," מסכם פרופ' שפרינצק.

תלמיד המחקר אודי בינשטוק עם פרופ' דוד שפרינצק.